
中大新闻网讯(通讯员章智琦)细胞膜在面对机械应力,例如血流剪切力时,是如何“撑不住”的?破裂是被动发生,还是可以被主动调控?6月9日,中山大学附属第一医院许杰团队和合作者为这个谜题提供了前所未有的答案。他们发现,一个名为 NINJ1 的跨膜蛋白,是控制细胞膜“脆不脆”的关键因子——它就像是调节膜稳定性的“安全阀”,一旦表达升高,细胞膜对机械力的耐受力就下降,轻轻一碰就“炸了”。相关成果发表在国际期刊《自然》上。
一张张可被拉伸的384孔板,撬开了细胞膜破裂背后的“力学密码”
为了回答“是谁让细胞膜破掉”的问题,研究团队原创设计开发了一套高通量细胞拉伸平台:他们在无底的384孔板底部封装PDMS弹性薄膜,通过控制气压来对每孔细胞施加精准的拉伸;同时,细胞内表达的YFP荧光蛋白作为感应器,一旦膜破裂,YFP迅速被进入细胞内部的氯离子猝灭,从而实现“谁破了、破多少”的快速自动化检测。
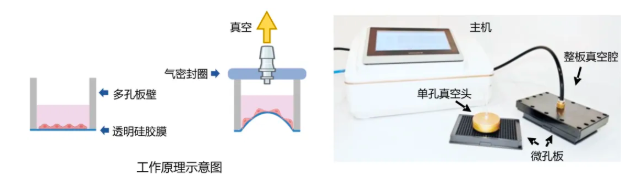
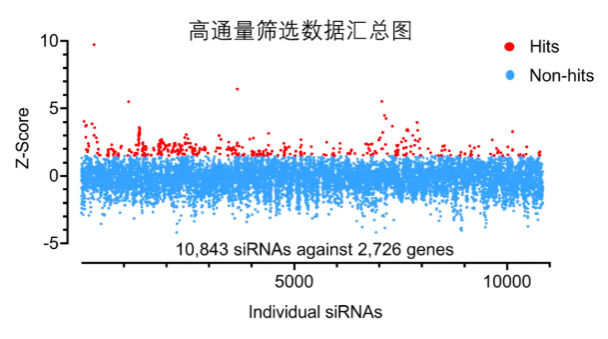
在这个平台上,研究者对2726个人类多跨膜蛋白进行了siRNA筛选,找出那些能增强或减弱细胞膜在拉伸状态下的完整性的基因。他们发现,排名第一的基因,是一个此前被认为在程序性细胞中起作用的蛋白:NINJ1。
NINJ1:不仅是“执行破裂”的终结者,更是“决定易裂”的预谋者
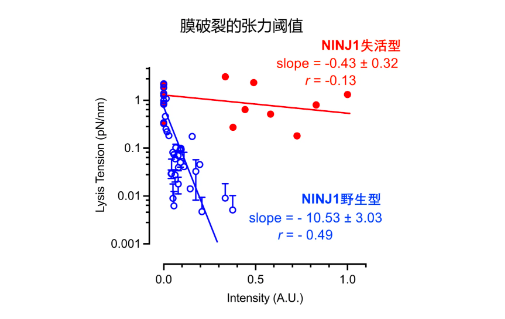
NINJ1(Ninjurin-1)这个名字在近年来因其在炎性坏死(pyroptosis)中诱导膜破裂而被广泛关注。但许杰团队的研究发现,即使在没有任何细胞死亡信号的背景下,NINJ1依然能“让膜变脆”。无论在THP-1、HeLa 还是293T细胞中,只要敲除NINJ1,细胞膜在拉伸应力下就显著更“抗压”;反之,如果激活或过表达NINJ1,即使应力水平不高,细胞膜也容易迅速破裂。更关键的是,这种破裂不是通过经典凋亡或坏死通路触发的,而是纯粹由膜的力学脆弱性增加所致。这意味着,NINJ1不仅是细胞破裂的“执行者”,还是将细胞置于“易裂状态”的策划者。
模拟血流剪切力:在类似生理流体环境中,NINJ1依然掌握“引爆权”
研究团队进一步使用体外流体刺激装置模拟体内血流环境,发现在剪切速率达到生理高值(>2000 s⁻¹)时,预处理的THP-1细胞若缺失NINJ1,即使受到强烈刺激,质膜破裂几率也较野生型大大减低,释放的双链DNA的等大尺寸DAMP也显著减少。也就是说,NINJ1 可能是连接“受伤”和“发炎”的那一环:如果没有它,细胞即使内在处于激活状态,也不太可能通过机械方式释放危险信号。
不是“感知”力,而是“制造”脆弱:从通道到裂口的概念性延伸
过去我们谈机械感应受体,往往指的是以PIEZO1/2为代表的机械力敏感离子通道,它们通过感知张力变化打开离子通路,引发钙流和信号转导。而NINJ1不是传统意义上的通道,而是能改变质膜的力学属性——让膜提前进入“易裂”的状态。研究人员推测,激活后的NINJ1成为了细胞膜上的脆弱点,通过多种可能性改变细胞膜的局部生物力学特性,降低细胞膜破裂的阈值,这就像给细胞膜局部打上了邮票撕拉孔,这让细胞膜从原本的“橡皮”变成了“玻璃”,一旦外力触发,就会发生破裂。
意义不止细胞死亡:新的免疫调控靶点?
在组织应力频繁变化的生理或病理状态下——比如创伤、肺部感染、血管损伤、肿瘤浸润等——细胞膜破裂与否,将直接决定炎症因子是否释放,免疫细胞是否聚集,局部组织是否进入持续激活状态。NINJ1作为一个调控膜破裂阈值的“开关分子”,无疑成为了炎症和免疫控制的潜在靶点。该研究为治疗主动脉夹层、创伤性脑损伤等力学相关疾病提供了新靶点,而针对NINJ1的抗体或小分子抑制剂,或将成为保护细胞膜、减轻组织损伤的新策略;同时其研发的高通量拉伸平台有望加速机械敏感离子通道抑制剂的开发。